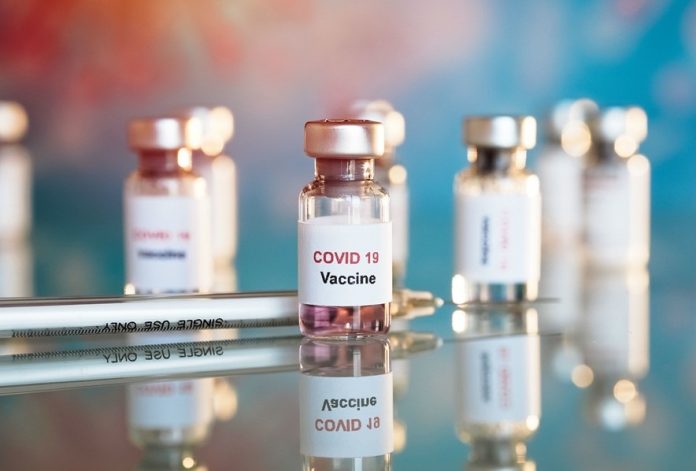
La vacuna contra Covid-19 del consorcio Pfizer-BioNTech fue aprobada por unanimidad en la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) a fin de hacer frente a la emergencia sanitaria.
“La buena noticia, hace pocos minutos concluyó el proceso de evaluación”, dijo el subsecretario de Prevención y Promoción de la Salud, Hugo López-Gatell la tardenoche de este viernes.
- Minutos después del anuncio en México, la Administración de Alimentos y Medicamentos de Estados Unidos dio a conocer su autorización a la misma vacuna, que el jueves ya había sido avalada por un comité externo de expertos.
- En un comunicado, la Cofepris, el órgano desconcentrado de la Ssa y responsable de la autorización de medicamentos y vacunas, indicó que desde el pasado 26 de noviembre revisó, evaluó y dictaminó la documentación ingresada para la autorización sanitaria por uso de emergencia de la vacuna Pfizer-BioNTech.
“El Comité de Moléculas Nuevas sesionó el 11 de diciembre de 2020, donde sus 24 miembros votaron y emitieron una opinión favorable, de forma unánime, para su uso de emergencia”.
“Por lo que la Cofepris ha dictaminado procedente la autorización para uso de emergencia de la vacuna Pfizer-BioNTech Covid-19, con el fin de ser utilizada en la Política Nacional de Vacunación contra el virus SARS-CoV-2 para la prevención de la Covid-19”.
Además de Estados Unidos, y ahora México, también han avalado esta vacuna los gobiernos de Reino Unido, Canadá y Baréin. “(Ahora) se agrega México… la Cofepris le ha conferido el uso en emergencia contra el virus SARS-CoV-2 y esto es un motivo de esperanza y tranquilidad”.
- La de Pfizer-BioNTech será la primera vacuna contra el Covid-19 disponible en nuestro país y en todo el mundo.
- Utiliza una plataforma novedosa de RNA mensajero con requerimientos especiales de almacenamiento a menos 70 grados centígrados.
- Tiene una vida útil de cinco días a temperaturas entre dos y ocho grados y de seis horas una vez que se descongela y se reconstituye.
El Gobierno mexicano pactó con la empresa la compra de 34.4 millones de dosis, que servirán para vacunar a 17.2 millones de personas (dos dosis por paciente). Un primer lote de 250 mil dosis empezará a aplicarse en la tercera semana de diciembre a 125 mil médicos, enfermeras y demás personal de Salud que está en la primera línea de combate a la pandemia.
- Los hospitales privados también están incluidos en esta primera fase, por lo que se les ha solicitado establecer las listas de priorización en su personal que atiende en la primera línea a pacientes con el virus.
La prioridad son los adultos mayores y grupos vulnerables
El secretario de Relaciones Exteriores (SRE), Marcelo Ebrard, se congratuló en su cuenta de Twitter por la decisión de la autoridad sanitaria.
“Gracias Dr. (José Alonso) Novelo, director de la Cofepris, Martha Delgado, subsecretaria de SRE, Dr. (Jorge) Alcocer y Hugo López-Gatell, secretario y subsecretario de Salud y a tod@s quienes hicieron posible esta primera autorización de una vacuna contra Covid-19 en México!!! (sic)”, expresó el Canciller mexicano.
De ese modo las etapas y lapso de tiempo de la estrategia de vacunación se dividirá de la siguiente manera:
- Primero será para los trabajadores de la salud, que se ubican en el primer frente de lucha contra COVID-19 de (diciembre de 2020 – febrero 2021)
- Luego será el personal de salud restante y personas de 60 años y más (febrero – abril 2021)
- Posteriormente se aplicará la dosis a personas de 50 a 59 años (abril – mayo 2021)
- En la etapa cuatro se incluirá a ciudadanos de 40 a 49 años (mayo – junio 2021)
- Finalmente el resto de la población de (junio -marzo 2022)
Plan de Vacunación aún deja en el aire aspectos clave
El anuncio oficial de los grupos prioritarios que próximamente recibirán la vacuna contra el COVID-19, en un despliegue que hasta el momento solo contempla el fármaco desarrollado por Pfizer-BioNTech, es solo la primera parte de una estrategia nacional de la que todavía falta conocer detalles, aseguraron expertos del sector.
- Uno de los puntos que aún no están claros —señalaron— es de qué manera las autoridades garantizarán la adecuada distribución de las dosis, que requieren ciertas condiciones para su conservación.
El gobierno federal señaló este martes que ya está listo un documento con todo el plan, el cual se irá presentando por etapas y conforme se avance en la aprobación de vacunas, por lo que hasta el momento solo se tiene previsto lo que se hará en la primera etapa con la vacuna de Pfizer-BioNTech.
En conferencia de prensa, las autoridades explicaron que los profesionales de la salud serán los primeros en vacunarse con el primer lote de Pfizer, el cual se prevé que llegue a México en la tercera semana de diciembre. Posteriormente se irá abarcando a más grupos poblacionales, de mayor a menor edad.
- Asimismo, se expuso que el Ejército ayudará en la distribución y custodia, que las primeras entidades en aplicar las vacunas serán la Ciudad de México y Coahuila, y que Pfizer apoyará en la transportación del fármaco debido a que tiene requerimientos especiales, como que debe ser conservado a menos de 70 grados.
- Xavier Tello, analista en políticas de salud, considera que en lo presentado no hubo sorpresas en comparación con lo que se ha hecho con políticas internacionales o en cuanto a los grupos de riesgo prioritarios. Advierte también que las autoridades no dieron más detalles sobre, por ejemplo, cuál es la infraestructura para la recepción y aplicación de vacunas.
«Me hubiera sorprendido que nos mostraran esas cosas. Lo que sí es sorpresa es que tengan planificado en etapas a los grupos poblacionales, cuando no deberías ponerle fechas si no sabes que tienes la vacuna», señala el especialista.
- El experto cuestiona el hecho de que se haya dado un calendario, si el país por ahora no sabe a ciencia cierta qué vacunas tendrá y cuándo contará con ellas.
- Hasta el momento, el único contrato firmado es el de México con Pfizer por 34.4 millones de dosis, que alcanzan para 17 millones de personas porque cada usuario requiere tomar dos aplicaciones.
«Qué bueno que tienen visión de planeación, ¿pero si no hay vacunas? Me estaba esperando un cronograma realista que dijera ‘esto depende de esto y aquello’, pero tampoco sabemos cuáles son las vacunas que van a comprar», comenta.
- En general, las analistas ven bien que se priorice al personal médico: no solo a médicos, enfermeras y enfermeros, sino a todos los involucrados en la primera línea de combate al COVID-19.
No obstante, Josué Bautista, presidente de la Asociación Mexicana de Farmacovigilancia (AMFV), señala que a partir de la etapa tres —que contempla a personas de 50 a 59 años para la aplicación de la vacuna entre abril y mayo— no solo se debió tomar a la edad como factor determinante, sino que se debió considerar a otras poblaciones de riesgo que es clave inmunizar. Algunos ejemplos son:
- Trabajadores esenciales que no pertenecen al sector salud, como profesores, policías, bomberos, y trabajadores de los sectores de limpia, agricultura, transporte y alimentos.
- Comunidades en las que no es posible mantener distancia física o sana distancia, como las de prisiones, refugios y albergues.
- Trabajadores que no pueden mantener distancia física o sana distancia, por ejemplo, aquellos que laboran en las fábricas.
- Grupos vulnerables, como personas en situación de calle.
El punto fino del Plan de Vacunación
Los especialistas coinciden en que lo presentado contempla una etapa inicial y se deberán ir considerando más elementos hacia el futuro, como la distribución, el sistema de farmacovigilancia, el reforzamiento de los centros de atención primaria, así como las campañas de vacunación para llamar a la población a que se le aplique el fármaco.
- Baruch Díaz, académico de la Facultad de Medicina de la UNAM, expone que el siguiente paso es que se anuncie cuál será la estrategia fortalecida para cumplir con el esquema de vacunación y del Sistema Nacional de Farmacovigilancia, ya que, al tratarse de nuevas sustancias, es necesario contar con plataformas tecnológicas que recaben información de la aplicación y posibles efectos en tiempo real.
Bautista advierte que es necesario que se comunique y puntualice cómo operará la red de distribución, almacenamiento y aplicación de las vacunas conforme a las características de cada fármaco, porque no es lo mismo distribuir y aplicar la vacuna de Pfizer-BioNTech, que requiere ultracongelación (-70°C), a la de AstraZeneca, que no requiere ultracongelación pero sí una red de frío (de 2°C a 8°C). En estos casos, si las vacunas no son conservadas bajo estas condiciones, la inmunización no sería efectiva.
Además, los expertos aseguran que es necesaria una fuerte campaña de información para convencer a las personas de que se vacunen y, en el caso que se requieran dos dosis, que se apliquen ambas, pues de lo contrario no se alcanzará la llamada «inmunización de rebaño», con más de 60% de la población vacunada hacia el 2022.
- Para los especialistas, también es importante detallar cómo se llevará a cabo la trazabilidad de la aplicación y experiencia de uso, porque en la mayoría de las vacunas se incluye un esquema de dos dosis para tener la información necesaria ya en la etapa de aplicación.
- «Reconocemos y apoyamos el interés que tiene el gobierno de México para una exitosa ejecución del Plan de Vacunación para COVID-19, pero consideramos que hay otros elementos que deben considerarse e integrare a este plan en aras de poder maximizar el uso de estas nuevas vacunas y proteger a la población de riesgos», comenta Bautista.
- Los expertos insisten en que es un plan inicial que podría irse modificando conforme vayan avanzando los proyectos de vacuna y la disponibilidad que tenga México. «Es un plan que va a ser flexible mientras vayamos adentrándonos a las autorizaciones. Lo estamos viviendo en tiempo real, nada está escrito», dice Díaz.
Por su parte, Tello considera que, hasta que no se conozca el detalle fino y el plan por escrito, habrá muchas dudas. «De entrada es un buen inicio pero nada más, te dicen qué van a hacer este momento con la vacuna de Pfizer, que es la que se tiene; todo lo demás es un plan bastante escueto, no creo que aporte más de lo que estábamos esperando», afirma./Agencias-PUNTOporPUNTO